近日,我司张凌研究员课题组在类风湿性关节炎靶向治疗方面取得新进展。该研究成果发表于Signal Transduction and Targeted Therapy期刊,题为“Metabolic reprogramming of proinflammatory macrophages by target delivered roburic acid effectively ameliorates rheumatoid arthritis symptoms”。
目前,类风湿性关节炎的临床治疗药物多通过直接抑制炎症信号通路发挥抗炎作用、因而靶向性差;又因类风湿性关节炎本身病程长和进展性的发病特点,大量患者在按照疗程长期、高剂量给药后出现了严重的不良反应以及耐药现象。因此,开发靶向性更好、且异于常见抗炎药物机制的类风湿性关节炎治疗手段可能有利于显著提高其治疗效果。
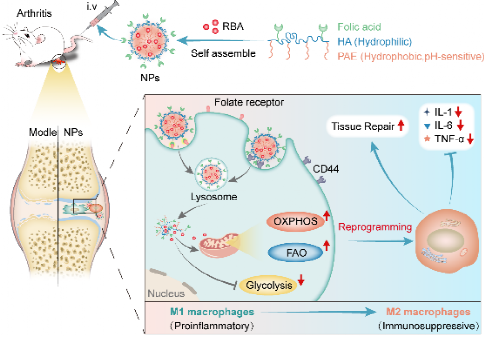
研究表明,巨噬细胞在接受不同刺激后可极化为多种不同表型,根据其功能、表面受体类型和代谢特征等可大致分为促炎型巨噬细胞(M1)或抗炎型巨噬细胞(M2)两类。M1/M2的平衡在维持类风湿性关节炎免疫稳态和防止过度免疫方面起到重要作用。鉴于巨噬细胞在类风湿性关节炎病理过程中的重要启动和调控作用,以及促炎性M1型巨噬细胞高表达CD44和Folate受体的理论基础,本研究设计构建了一种搭载栎樱酸(roburic acid,RBA)的pH响应型双靶向递药系统(RBA-NMs)用于靶向治疗类风湿性关节炎。本研究利用组学和分子生物学研究工具等,首次从能量代谢角度,揭示了RBA-NMs通过抑制ERK/HIF-1α/GLUT1通路下调糖酵解水平,以代谢重编程方式驱动巨噬细胞M1→M2型转化的分子机制。同时,体外和动物模型实验结果表明该递送系统具有良好的RA病理靶向功能,并能够显著减轻RA症状。RBA-NMs具有以下优势:①改善RBA溶解性和生物利用度;②提高RBA在RA部位的有效蓄积;③提升RBA对RA症状的治疗效果,同时降低RBA毒性。本研究为RA治疗药物靶向递送载体系统的设计和应用提供了新思路,发现了RBA的新生理作用机制,并为探索RA治疗的潜在分子靶点提供了新见解。
我司2020级博士研究生贾娜为论文的第一作者,张凌研究员为论文的通讯作者。本研究受国家优秀青年科学基金项目(82022070)和区域创新发展联合基金(No: U20A20411)的支持。原文链接:https://www.nature.com/articles/s41392-023-01499-0,DOI: 10.1038/s41392-023-01499-0
撰稿:张凌、贾娜
编辑:杨燕玲
审核:刘向阳